研究活動の検索
研究概要(研究室ガイド)やプレスリリース・受賞・イベント情報など、マテリアルサイエンスの研究室により公開された情報の中から、興味のある情報をタグや検索機能を使って探すことができます。磁性-プラズモンハイブリッドナノ粒子を用いて、従来分離が難しかった細胞小器官(オートファゴソームなど)の新たな分離法の開発に成功

磁性-プラズモンハイブリッドナノ粒子を用いて、従来分離が難しかった
細胞小器官(オートファゴソームなど)の新たな分離法の開発に成功
ポイント
- これまで分離が難しかった細胞小器官を磁気分離するためのプローブとして、粒径約15 nmで単分散なAg/FeCo/Agコア/シェル/シェル型磁性-プラズモンハイブリッドナノ粒子を創製した。
- ハイブリッドナノ粒子を哺乳動物細胞に取り込ませ、培養時間を変化させた際、ナノ粒子が細胞内のどの部分に局在するかということをAgコアのプラズモン散乱を利用して可視化することに成功した。
- 培養時間が30分~2時間の間でハイブリッドナノ粒子がオートファゴソームに局在することがわかったため、オートファゴソームをターゲットとして、適切な時間帯で細胞膜を破砕して磁気分離を行うことでオートファゴソームの分離に成功した。
- 単離したオートファゴソームをプロテオミクス/リピドミクス解析に供することで、オートファジーの機能欠損による疾患の創薬へと展開できる可能性がある。
- リガンド結合ハイブリッドナノ粒子を用いた汎用的かつ高選択的な細胞小器官分離技術へと拡張することで、基礎生物学上重要な発見を導く可能性があるほか、肥満や老化を防止する医療技術へと繋がることも期待される。
|
北陸先端科学技術大学院大学(学長・浅野哲夫、石川県能美市)、物質化学領域の前之園 信也 教授らは、東京大学、金沢大学ほかと共同で、独自開発の磁性-プラズモンハイブリッドナノ粒子を用いてオートファゴソームのイメージングと磁気分離に成功しました。この手法は、これまで分離が困難であった他の細胞小器官へ拡張可能なため、新たな細胞小器官分離法としての応用が期待されます。 2013年のノーベル生理学・医学賞は、「小胞輸送の分子レベルでの解析と制御メカニズムの解明」という功績に対して、米国の3名の研究者に贈られました。また、2016年のノーベル生理学・医学賞は、「オートファジー注1)の分子レベルでのメカニズムの解明」の功績に対して、東京工業大学・大隅 良典 栄誉教授に贈られたことはまだ記憶に新しいところです。これらの研究はいずれも"細胞内物質輸送"に関するものでした。細胞内物質輸送には多種多様な細胞小器官注2)が関与しており、それらの機能は細胞小器官に存在するタンパク質や脂質によって制御されています。従って、細胞小器官の機能を理解するためには、そこに存在するタンパク質/脂質を調べることが必要不可欠です。そのための有力な手段の一つとして、タンパク質/脂質が機能している小器官ごと単離して解析するという方法があります。細胞小器官の一般的な単離法には超遠心分離注3)がありますが、比重に差が無い異種の小器官の分離は困難であることに加え、分離工程が煩雑で手間がかかるほか、表在性タンパク質注4)の脱離や変性が問題となる場合もあるため、新たな分離法の開発が望まれています。 本成果は、アメリカ化学会が発行するオープンアクセスジャーナルであるACS Omega誌に2017年8月25日に掲載されました。 |
<今後の展開>
単離したオートファゴソームをプロテオミクス/リピドミクス解析に供することで、これまでとは異なる視点からオートファジーを俯瞰でき、オートファジーの機能欠損による疾患の創薬へと展開できる可能性があります。また、ハイブリッドナノ粒子表面に所望のリガンドを結合させることによって、目的の細胞小器官への受容体を介したターゲティングが可能なナノ粒子を作製し、そのリガンド結合ナノ粒子を用いて標的細胞小器官を高選択的に単離する技術を確立することで、基礎生物学上重要な発見を導く可能性があります。さらに、肥満や老化を防止する医療技術へと繋がることも期待されます。

図1 磁性-プラズモンハイブリッドナノ粒子を哺乳動物細胞にトランスフェクションした後、培養時間(図中右に行くに従って培養時間が長いことを意味する)とともにナノ粒子の局在が初期エンドソーム(early endosome)、オートファゴソーム(autophagosome)、オートファゴリソソーム(autophagolysosome)へと移行する様子をプラズモン散乱を利用した共焦点顕微鏡イメージングで確認でき、各々の時間帯で磁気分離を行うとそれぞれ異なる種類の細胞小器官を分離することが可能であることを示した図。
<論文>
| 掲載誌: | ACS Omega |
| 論文題目: | "Magnetic Separation of Autophagosomes from Mammalian Cells using Magnetic-Plasmonic Hybrid Nanobeads"(磁性-プラズモンハイブリッドナノ粒子を用いた哺乳動物細胞からのオートファゴソームの磁気分離) |
| 著者: | Mari Takahashi,1 Priyank Mohan,1 Kojiro Mukai,2 Yuichi Takeda,3 Takeo Matsumoto,4 Kazuaki Matsumura,1 Masahiro Takakura,5 Hiroyuki Arai,2 Tomohiko Taguchi,6 Shinya Maenosono1* 1北陸先端科学技術大学院大学 2東京大学大学院薬学系研究科 衛生化学教室 3大阪大学大学院医学系研究科 4金沢大学医薬保健研究域医学系 5金沢医科大学産科婦人科 6東京大学大学院薬学系研究科 疾患細胞生物学教室 |
| DOI: | 10.1021/acsomega.7b00929 |
| 掲載日: | 2017年8月25日 |
<用語解説>
注1)オートファジー
オートファジー(Autophagy)は、細胞が持っている、細胞内のタンパク質を分解するための仕組みの一つ。自食とも呼ばれる。酵母からヒトにいたるまでの真核生物に見られる機構であり、細胞内での異常なタンパク質の蓄積を防いだり、過剰にタンパク質合成したときや栄養環境が悪化したときにタンパク質のリサイクルを行ったり、細胞質内に侵入した病原微生物を排除することで生体の恒常性維持に関与している。
注2)細胞小器官
細胞の内部で特に分化した形態や機能を持つ構造の総称。細胞内器官やオルガネラとも呼ばれる。細胞小器官が高度に発達していることが、真核細胞を原核細胞から区別している特徴の一つである。
注3)超遠心分離
数万G(重力加速度)以上の遠心力をかける遠心分離法。
注4)表在性タンパク質
疎水性相互作用、静電相互作用など共有結合以外の力によって脂質二重層または内在性膜タンパク質と一時的に結合しているタンパク質。
注5)超常磁性
強磁性体やフェリ磁性体のナノ粒子に現れる。磁性ナノ粒子では磁化の向きが温度の影響でランダムに反転しうる。この反転が起こるまでの時間をネール緩和時間という。外場の無い状態で、磁性ナノ粒子の磁化測定時間がネール緩和時間よりもずっと長い時、磁化は平均してゼロであるように見える。この状態を超常磁性という。
注6)エンドサイトーシス
細胞が細胞外の物質を取り込む過程の一つ。細胞に必要な物質のあるものは極性を持ちかつ大きな分子であるため、疎水性の物質から成る細胞膜を通り抜ける事ができない、このためエンドサイトーシスにより細胞内に輸送される。
注7)オートファゴソーム
オートファジーの過程で形成される二重膜構造を有した袋状の細胞小器官。他の細胞小器官やタンパク質などを囲い込んだ後、リソソームと融合することで内容物を消化する。
注8)プラズモン
プラズマ振動の量子であり、金属中の自由電子が集団的に振動して擬似的な粒子として振る舞っている状態をいう。金属ナノ粒子ではプラズモンが表面に局在することになるので、局在表面プラズモンとも呼ばれる。
注9)トランスフェクション
人為的にDNAやウイルスなどを細胞に取り込ませる手法。
注10)プラズモン散乱イメージング
局在表面プラズモン共鳴に起因した光散乱を利用したイメージング。共焦点顕微鏡を用いたバイオイメージングでは一般的に蛍光色素が用いられるが、長時間観察では光退色が問題となる。しかし、プラズモン散乱を用いたイメージングでは光退色の心配がない。
注11)蛍光免疫染色
抗体に蛍光色素を標識しておき、抗原抗体反応の後で励起光を照射して蛍光発光させ、共焦点顕微鏡などで観察することによって本来不可視である抗原抗体反応(免疫反応)を可視化するための組織化学的手法。
注12)初期エンドソーム
初期エンドソームは、エンドサイトーシスされた物質を選別する場として機能する細胞小器官である。エンドサイトーシスによって細胞内へと取り込まれた物質は、まず細胞辺縁部に存在する初期エンドソームへと輸送される。初期エンドソームを起点として、分解される物質は分解経路へと、細胞膜で再利用される物質はリサイクリング経路へと選別されていく。
注13)オートファゴリソソーム
オートファゴソームとリソソームの融合によってできる細胞小器官。
注14)ウェスタンブロッティング
電気泳動によって分離したタンパク質を膜に転写し、任意のタンパク質に対する抗体でそのタンパク質の存在を検出する手法。
注15)LC3-II
LC3はオートファゴソームマーカーとして広く知られている。オートファジーが開始されると、LC3はプロペプチドとして発現し、直ちにC末端が切断されて細胞質型のLC3-Ⅰとなる。LC3-ⅠのC末端にホスファチジルエタノールアミンが付加され、膜結合型のLC3- IIへ変換する。LC3- IIはオートファゴソーム膜へと取り込まれて安定に結合するため、哺乳動物におけるオートファゴソーム膜のマーカーとして用いられている。
平成29年8月25日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2017/08/25-1.htmlエクセレントコアシンポジウムの開催について
標題について、エクセレントコア「天然マテリアル」研究拠点シンポジウム(第11回サクラン研究会 年次大会)を下記のとおり開催しますので、ご案内いたします。
本シンポジウムは、天然マテリアル、特に本学にて発見されたサクランに関する研究のさらなる発展を目指し、幅広い分野の研究者との相互交流・意見交換を行うために本学のエクセレントコア「高性能天然由来マテリアル開発拠点」及びサクラン研究会が開催するものです。
参加は無料となっており、事前の参加申込み等も必要ありませんので、奮ってご参加下さい。
| 開催日時 | 令和元年10月25日(金) 10:00~17:50 |
| 会 場 | マテリアルサイエンス系 小ホール |
| プログラム | 司会 金子 達雄 北陸先端科学技術大学院大学 教授(環境・エネルギー領域)
座長 三俣 哲 新潟大学 研究教授
座長 岡島 麻衣子
|
生命機能工学領域の藤本研究室の論文がWiley社刊行Chemistry an Asian Journal誌の表紙に採択
生命機能工学領域の藤本 健造教授、中村 重孝助教らの論文がWiley社刊行Chemistry an Asian Journal誌の表紙に採択されました。
■掲載誌
Chemistry an Asian Journal (IF=3.692) volume 14, Issue 11, 2019
■著者
Kenzo Fujimoto(教授)、Hung Yang-Chun(2017.3修了)、Shigetaka Nakamura(助教)
■論文タイトル
Strong Inhibitory Effects of Antisense Probes on Gene Expression through Ultrafast RNA Photocrosslinking
■論文概要
今回藤本研究室のグループは、乳癌由来の培養細胞であるHeLa細胞を用い、モデル系である標的遺伝子の発現を、超高速光架橋型人工核酸(CNVD)を組み込んだDNAプローブを用いることによりほぼ完全に抑制することに成功しました。光照射の場所やタイミングにより遺伝子発現を制御することができるため、疾患部位のみに薬効を発揮させることができます。また、光照射エネルギーにより遺伝子発現量を制御することができるため、細胞内遺伝子発現を最適な量に調節することが可能となりました。これにより従来は困難であった発現量の調節も可能となります。
今後、遺伝子の異常発現を伴う細胞の癌化に対し、有用な治療法となると期待できます。また、超高速光架橋核酸(CNVD)は日華化学株式会社より販売されており、本研究成果の普及に大きく寄与することが期待されます。
論文詳細:https://onlinelibrary.wiley.com/doi/full/10.1002/asia.201801917

平成31年6月11日
出典:JAIST お知らせ https://www.jaist.ac.jp/whatsnew/info/2019/06/11-2.html「光で細胞内遺伝子発現を制御することに成功」-核酸医薬への応用に期待-

「光で細胞内遺伝子発現を制御することに成功」
-核酸医薬への応用に期待-
ポイント
- 超高速光架橋型人工核酸(CNVD)を用いることで遺伝発現を制御可能
- 悪性遺伝子の発現抑制にも応用可能
|
北陸先端科学技術大学院大学(JAIST)(学長・浅野哲夫、石川県能美市)の先端科学技術研究科生命機能工学領域の藤本健造教授は、超高速光架橋型人工核酸(CNVD)を用いることにより細胞内の標的遺伝子の発現を制御することに成功した。
遺伝子の過剰発現*1は細胞の異常増殖などを引き起こし、細胞の癌化と深く関係している。核酸医薬*2は標的遺伝子に直接作用し、発現量を抑制することができるため、癌の治療薬として注目されているとともに、高い選択性を有するため副作用の低減も期待できる。しかし、これまで様々な人工核酸を用い、遺伝子の過剰発現を抑制する試みが行われてきたが、いまだ完全に抑制することはできていない。 今回藤本研究室のグループは、乳癌由来の培養細胞であるHeLa細胞を用い、モデル系である標的遺伝子の発現を、超高速光架橋型人工核酸*3(CNVD)を組み込んだDNAプローブ*4を用いることによりほぼ完全に抑制することに成功した。光照射の場所やタイミングにより遺伝子発現を制御することができるため、疾患部位のみに薬効を発揮させることができる。また、光照射エネルギーにより遺伝子発現量を制御することができるため、細胞内遺伝子発現を最適な量に調節することが可能となった。これにより従来は困難であった発現量の調節も可能となる。 今後、遺伝子の異常発現を伴う細胞の癌化に対し、有用な治療法となると期待できる。また、超高速光架橋核酸(CNVD)は日華化学株式会社より販売されており、本研究成果の普及に大きく寄与することが期待される。 本成果はWiley誌Chemistry-an Asian Journal(インパクトファクター 3.69)に表紙掲載論文として6月1日に公開される。 |
 |
細胞内での様子を表したイメージ図、光照射により超高速光架橋型人工核酸を含むDNAがターゲットmRNAに光架橋する様子 |
| 図1.光照射による細胞内遺伝子発現の光制御しているイメージ図 光応答性人工核酸を組み込んだDNAプローブを細胞内に導入し、光照射により細胞内遺伝子発現を抑制することに成功している。特に照射エネルギーを調節(リモコン)することにより発現量を制御することができ、リモートでも遺伝子発現量の調節に成功した。 |
|

図2. 光架橋型人工核酸を組み込んだDNAプローブによる遺伝子発現の抑制
光架橋型人工核酸を組み込んだDNAプローブを細胞内に導入し、光照射を行うと、標的のメッセンジャーRNA(mRNA)と光架橋する。それにより翻訳を阻害するため、遺伝子発現を抑制することが可能となる。

図3. 超高速光架橋型人工核酸(CNVシリーズ)
超高速光架橋型人工核酸(CNVシリーズ)は数秒の光照射でDNAやRNA間をつなげることができる。世界最高速を誇るCNVシリーズは藤本研究室オリジナルな分子であり、日華化学株式会社より販売が開始されている。
<今後の展開>
細胞の癌化の多くは遺伝子が傷つき、遺伝子の発現パターンが変化したことを原因とする。今回、光照射による発現量の制御は、遺伝子の過剰発現を伴う細胞の癌化に対し、その発現量を適切な範囲内に調節できる可能性を有しており、近年注目されている核酸医薬としての展開が期待される。
<用語解説>
*1 遺伝子の過剰発現
DNAにコードされた多くの情報はRNAへと転写された後、たんぱく質へ翻訳される。通常、この一連の流れは精密に制御されているが、何らかの原因でストッパーが外れたかのようにこのサイクルが回り続けることがある。これを遺伝子の過剰発現と呼び、細胞の癌化の一つの原因でもある。
*2 核酸医薬
医薬品の一つの種類であり、DNAやRNAなどを直接医薬品として用いる薬剤の総称。核酸類の高い配列認識能を利用し、標的とする分子のみに作用する分子標的薬の一種。これまで主流とされてきた抗体医薬とは異なり、副作用の低減が期待できる。近年、新たな医薬品として注目されており、すでに市販されているものもいくつかある。
*3 超高速光架橋型人工核酸
DNAやRNAなどの核酸同士を連結することができる人工核酸であり、有機化学的に合成される。特に、藤本研究室が報告しているCNVシリーズは数秒の光照射により反応する世界最高速の光架橋型人工核酸である。
*4 DNAプローブ
短鎖の合成DNAであり、今回の実験ではGFPのmRNAのアンチセンス核酸として機能する。配列を自由に設計することができるため悪性遺伝子に対し、設計することでその遺伝子発現を抑制することができる。
<論文>
| 掲載誌 | Chemistry an Asian Journal |
| 論文題目 | Strong Inhibitory effects of antisense probes on gene expression through ultrafast RNA photo-crosslinking |
| 著者 | Kenzo Fujimoto, Hung Yang-Chun, Shigetaka Nakamura |
| DOI | 10.1002/asia.201801917 |
令和元年6月1日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2019/06/01-1.html多糖が自らパーティション -光合成産物の多糖が乾燥下、センチメートルスケールの3次元空間を認識-

多糖が自らパーティション
-光合成産物の多糖が乾燥下、センチメートルスケールの3次元空間を認識-
PRポイント
- 「多糖が乾燥環境下、3次元空間を認識することを世界で初めて発見」
- 「乾燥によって析出した多糖の薄膜はナノメーターから階層的に整った構造で、新たなバイオマテリアルの設計手法が期待」
- 「天然高分子への展開」:今回、淡水性シアノバクテリア由来の多糖類を使用したin vitro実験によって新現象が確認されており、今後、他の多糖や天然高分子などでも展開を検討
|
北陸先端科学技術大学院大学(学長・浅野哲夫、石川県能美市)、環境・エネルギー領域の桶葭興資助教、金子達雄教授らは、シアノバクテリア由来の多糖が自ら乾燥環境でセンチメートルスケールのパターンを形成することを発見した。多糖と乾燥環境は自然界で密接な関係にあり、今回のin vitro実験で「多糖が空間を認識する能力」が実証されただけでなく、簡便な乾燥によってバイオマテリアルの新たな設計手法が見出されると期待される。 自然界では熱帯魚の縞模様や巻貝のらせんなど様々な幾何学模様がセンチメートル以上のスケールで存在し、パターン発生原理の議論は歴史的研究の一つである。例えば、人工的に化学物質を選択してチューリングパターンやベローソフ・ジャボチンスキー反応など、パターン発生原理の研究が世界的に何世紀にも渡ってなされてきた。しかし、「自然界にある物理化学的な条件を再現して人工的にパターンを制御すること」はこれまで困難を極めていた。 これに対して研究チームは今回、シアノバクテリア由来の多糖が乾燥環境下、センチメートルスケールで空間分割パターンを形成することを発見した。多糖の水溶液を狭い間隙の制限空間から乾燥させると、1つの空間を複数の空間に分けるように多糖が析出する(図)。蒸発時、多糖は気液界面を増加させようとして界面を分割して薄膜として析出した。このように空間がパーティション化される現象はin vitro実験で確認されたもので、自然環境の多糖が乾燥と常に対面していることと密接に関係する。特に、今回使用した多糖は、シアノバクテリアが光合成によって生み出したサクランという生体適合性に優れた物質を用いているため、再生医療用材料としても有望である。
本成果は、英国科学雑誌「Scientific Reports」誌に7/21午前10時(英国時間)オンライン版で公開された。 |
<論文情報>
掲載誌:Scientific Reports
論文題目:Emergence of polysaccharide membrane walls through macro-space partitioning via interfacial instability.
著者:Kosuke Okeyoshi, Maiko K. Okajima, Tatsuo Kaneko
DOI: 10.1038/s41598-017-05883-z
掲載日:7月21日午前10時(英国時間)にオンライン掲載
|
本研究成果は、以下の事業・開発課題によって得られました。 |
<背景と経緯>
建築学で駆使されている3次元的な幾何構造は、自然対数を利用した橋の設計など自然界と調和した形状である。材料学においても自然界と調和する幾何形状や規則性の制御によって新しい材料設計方法が期待され続けている。しかし、「自然界にある物理化学的な条件下を再現して人工的に幾何学パターンを制御すること」はこれまで困難を極めていた。
自然界では熱帯魚の縞模様や巻貝のらせんなど様々な幾何学模様がセンチメートル以上のスケールで存在し、パターン発生の議論は歴史的研究の一つである。例えば、人工的に化学物質を選択してチューリングパターン注1)やベローソフ・ジャボチンスキー反応注2)など、パターン発生原理の研究が世界的になされてきた。さて、生物の体表などのパターンはなぜできるのか?遺伝子?天気?それとも..?果たして「人工的な実験」で、「ビーカーの中」で、科学によって再現できるのか?
<今回の成果>
1.乾燥環境下で多糖が3次元空間を認識することを発見(図1)
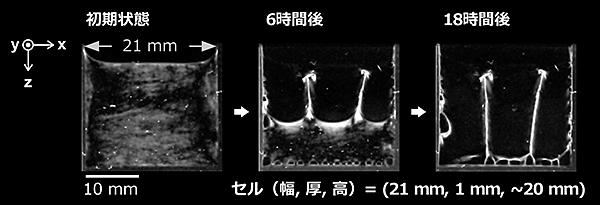
乾燥環境下、シアノバクテリア注3)由来の多糖注4)がセンチメートルスケールの3次元空間を認識して、自らパーティションとなるように析出膜を形成することを発見した。この現象はin vitro注5)実験で確認されたもので、高粘性の多糖「サクラン」注6)の水溶液を2枚のガラス板に挟まれた間隙の制限空間から乾燥させると、1つの空間を複数の空間に分けるように多糖が析出する。
初期状態:間隙1 mmの上面開放型セルに多糖の水溶液を満たす。セルの幅をセンチメートルスケールで様々に変えて乾燥実験を行った。
乾燥過程:セルの幅が0.7 cm 程度であると、2枚のガラス板を橋掛けするような析出膜は形成されず、底に析出するだけであった。これに対して、1.5 cm 容器の幅を広げると、2枚のガラス板を橋掛けするような析出膜が形成された。高分子のサイズからすれば、1 mm の間隙は著しく大きいにもかかわらず、橋掛けできることは驚異に値する。これは、多糖が自己集合的に20 µm以上の長さのファイバー状となっていることが関係する。さらにセルの幅を広げると垂直に析出する膜の数は増え、3次元空間が複数に分けられた。幅が10 cmの場合でもこの現象は確認され、多糖が乾燥時に自らパーティションとなる析出膜を形成し、センチメートル空間を認識可能であることを裏付けている。
2.垂直に析出した膜は、高分子がナノメータースケールから3次元的に揃っている(図2)
さらに、この析出膜を偏光顕微鏡や電子顕微鏡で観察すると、2枚のガラス板を結ぶ方向に、高分子が整然と揃っていることが判明した。多糖の水溶液を乾燥するだけで高分子が3次元的に方向制御されることは極めて驚異である。
この析出膜に架橋構造を導入したあと水に再び戻すと、遮光用ブラインドのように一方向に大きく伸びる。図2中の青いまま伸びている様子は、高分子の3次元的な整列を保ったまま一方向に伸びていることを示す。
なお、研究チームはこれまでにも、層状構造を持つ膜から一次元膨潤するゲルの作製に成功している。今回の新たな膜作製技術と合わせてバイオマテリアルへの応用が期待できる。
<今後の展開>
パーティション現象を他の天然高分子へ展開
物理化学的な条件と幾何学的な条件を整えることで、他の多糖や高分子へ展開可能である。特に「乾燥環境」に注目して、パターンの形成法則を系統的に解明することで、陸上進出する多糖の進化を紐解けるかもしれない。
パターンが多糖で構成されているため、新たなバイオマテリアル設計手法が期待される
センチメートル以上の空間パターンを自発的に形成する構造には、リーゼガング現象やチューリング現象など自己組織化による「散逸構造」が挙げられる。しかしこれらの現象は、生体が存在し得る自然界の物理化学条件から遠く離れた環境でのみ可能で、材料分野への適用は困難を極めていた。
一般に、多糖、DNAおよび骨格タンパク質などの剛直な生体高分子はナノメートルやマイクロメートルスケールのパターンを形成することが知られている。ポリペプチドのαヘリックスやβシート、DNAの螺旋構造はその代表例である。これに対して研究チームが発見したパーティション現象は、光合成産物の多糖を使って発見したセンチメートルスケールの空間パターンであり、散逸構造を用いた材料学の道が一気に開かれる。さらに、DDSなど医療用材料に期待の大きい多糖を使用していることから、臓器の再生医療などに向けた新たな材料設計手法として有望である。
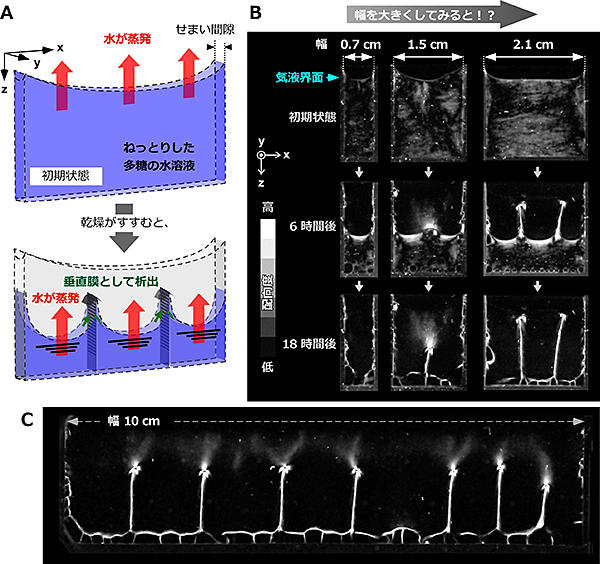
図1. 多糖の乾燥実験とパーティション現象
A. 上面開放型セルから多糖の水溶液を乾燥させる実験の概念図。
B. 様々な幅からの乾燥過程を2枚の偏光子を介して観察した画像。白色部分は高分子が配向している(揃っている)。
C. 幅10 cmの上面開放型セルから乾燥させたあとに現れる空間分割パターン。

図2. 析出した垂直膜の顕微鏡観察と瞬時に一方向へ膨らむゲル
乾燥実験後に析出した垂直膜を特殊な光学フィルターが入った偏光顕微鏡で観察すると、2枚のガラス板を結ぶ方向に高分子が整然と配向していることが分かる。さらにこの乾燥した膜を水にもどすと、「窓のブラインド」のように瞬時に一方向へ膨らむことが分かった。
<用語解説>(Wikipedia より)
注1)チューリングパターン:
イギリスの数学者アラン・チューリングによって1952年に理論的存在が示された自発的に生じる空間的パターンである。
注2)ベローソフ・ジャボチンスキー反応:
系内に存在するいくつかの物質の濃度が周期的に変化する非線型的振動反応の代表的な例として知られている。この反応などの振動反応は平衡熱力学の理論が成り立たない非平衡熱力学分野の代表例である。
注3)シアノバクテリア:
ラン藻細菌のこと。光合成によって酸素と多糖を生み出す。
注4)多糖:
グリコシド結合によって単糖分子が多数重合した物質の総称である。デンプンなどのように構成単位となる単糖とは異なる性質を示すようになる。広義としては、単糖に対し、複数個(2分子以上)の単糖が結合した糖も含むこともある。
注5)in vitro:
"試験管内で"という意味で、試験管や培養器などの中でヒトや動物の組織を用いて、体内と同様の環境を人工的に作り、薬物の反応を検出する試験のことを指す。in vitroの語源はラテン語で「ガラスの中で」という意味。
注6)サクラン:
硫酸化多糖類の一つで、シアノバクテリア日本固有種のスイゼンジノリ (学名:Aphanothece sacrum) から抽出され、重量平均分子量は2.0 x 107g/mol とみつもられている。
平成29年7月21日
出典:JAIST プレスリリース https://www.jaist.ac.jp/whatsnew/press/2017/07/21-1.html環境・エネルギー領域の桶葭助教が三谷研究開発支援財団の研究開発助成に採択
環境・エネルギー領域の桶葭興資助教が三谷研究開発支援財団の研究開発助成に採択されました。
三谷研究開発支援財団は、財団法人三谷育英会の姉妹財団として、平成17年3月10日に設立され、今年で11年目を迎えました。三谷育英会は、三谷産業株式会社を創業した故 三谷進三氏の個人資産を基に、1960年設立され、以来、高等学校並びに大学に学ぶ学生に対し奨学金による支援が続けられております。2005年、三谷育英 会の設立45周年に際し、当時、三谷育英会の二代目理事長であった三谷美智子氏は「三谷育英会の奨学生が学ぶ大学の研究室で進められる研究開発に対しても、何か支援することが出来ないか」と思い、自身の持つ三谷産業株式会社株式200万株等を基に当財団を設立いたしました。当財団は、将来を担う研究者の 方に更に研究に邁進していただくため、石川県内の大学および大学院で行われている有益な研究に対し援助することを目的としています。なお、平成24年4 月より当財団は石川県の認定を受け、財団法人から公益財団法人へ移行し、新たな第一歩を踏み出しました。当財団は、石川県地域に立地する研究機関、すなわ ち大学及び大学院で行われている研究開発に対し、支援、表彰等を行い、もって地域の研究開発と産業の発展に寄与することを目的とします。
■採択期間
平成28年度
■テーマ
「乾燥誘起による超高分子多糖類の一軸配向膜作製技術の開拓」(天然高分子機能創発チーム)
■テーマ概要
自然界の生命が常に対面している乾燥現象を利用して、自然法則に基づいた高分子配向制御法の新機軸を構築する。特に、シアノ バクテリア由来高分子多糖類の水溶液の乾燥過程に着目し、高秩序化された高分子膜の作製技術を開拓する。乾燥による一軸配向膜作製の新たな技術を確立することで、細胞足場材料など医療分野や分子認識材料など環境分野への応用が期待できる。産業界においても高秩序化されたバイオ分子修飾基板の作製は、IPS 細胞培養用はじめ早急に解決すべき問題である。
■採択にあたって一言
本研究課題について採択頂き大変嬉しく存じます。三谷研究開発支援財団、および本助成の選考委員会の皆様に深く感謝申し上げます。また、金子達雄教授はじめ、共同研究者の皆様、ご助言頂いた研究室の皆様にこの場をお借りして深く御礼申し上げます。科学と技術の発展に貢献できる様誠心誠意励んで参ります。
平成28年6月6日
出典:JAIST お知らせ https://www.jaist.ac.jp/whatsnew/info/2016/06/06-1.html