ポストゲノムにおける新規 遺伝子操作法開発_old
1.はじめに
人間の全てのDNA塩基配列が既に明らかになり、今後世界中で凌ぎをけずって行なわれるのは、病気の原因遺伝子を同定し、遺伝子診断、遺伝子治療、さらにはゲノムに基づく創薬に結びつける研究である。2020年の米国のゲノム・バイオ関連の総売上高は400兆円にも及ぶと予想されている。ポストゲノムの時代にはいると、遺伝子のある特定のサイトを自在にブロックするドラッグ(アンチセンス、アンチジーン)のデザインも重要となってくる。また、病気の原因遺伝子の同定や遺伝子診断には、膨大なDNA 塩基対のマーカーとなるSNP (1塩基多形)を検知することも欠かせない。
一方、現在の蛋白工学の基礎となっているのは、1960年代以降発展してきた遺伝子工学であり、さまざまな制限酵素やポリメラーゼの発見、PCR、DNAシーケンシング法など多くのノーベル賞受賞者を出してきた。こうしった既存のバイオテクノロジーが現在の遺伝子診断・及び生化学分野における基礎研究等に不可欠のものとなっている。しかし、酵素を用いた場合、酵素濃度、pH、温度といった既約条件によりその使用に際して様々な制限を受けている。
本研究室では、これまでの酵素を用いた遺伝子操作とは全く異なる、光を用いてDNAをつないだり切ったりする遺伝子の操作手法論について開発を行うと共にこの技術の応用を行い、ポストゲノム時代において役割を果たすことを目的とする。
2.核酸の連結
核酸を連結する方法は酵素的連結・化学的連結に大きく分類することができる。また、化学的連結においてはさらに有機化学的連結・光化学的連結に分類することができる。それぞれの連結反応についての特徴を以下に述べる。
2-1.酵素的連結
一般的な連結手法であり、T4DNAリガーゼが最もよく使用される。テンプレートとなる核酸存在下でほぼ定量的な連結が可能である。遺伝子工学上の最も基礎的な操作の一つとして用いられ、最近ではSNPsの検出等の遺伝子診断の領域でも多用されている。ただし、酵素的連結には至適pH・至適温度・至適塩濃度とった様々な既約条件がある。
2-2. 有機化学的連結
ブロモシアンを活性化剤として用いることで核酸連結が可能であるが、ブロモシアンが非常に毒性が高く、扱いが困難である。またジスルフィド結合による連結やフォスフォチオエート結合による非天然型の連結反応も知られている。
2-3.光化学的連結
有機化学的連結と比較し緩和条件で扱える点、また酵素的連結と比較しても既約条件が殆ど無い点等、将来的に細胞内等での利用を考えた際に最も実用的である。今まで、ソラレンを持つ人工核酸を用いることで光連結、チオウリジンを用いた光連結等が知られている。これらの場合、連結収率が低収率であることや、副反応として鋳型核酸との連結が起こるといった問題点があった。
3.光連結のための人口修飾核酸の設計及びその反応性
3-1.光連結性核酸塩基の設計
光による核酸損傷の一つとしてピリミジン連続配列におけるダイマー生成が知られている。スタッキングしている上下のピリミジンが光化学的に[2+2]光環化反応によって連結されるこの生体内自然現象を参考に分子設計を行った。天然の塩基のチミンをビニル基で置換した5-ビニルデオキシウリジン(VU)を用いることにした。ビニル基はチミンのメチル基と比較して分子サイズに大きな差異はなく、また連結対象となるピリミジンに対して、より効率的なスタッキングが期待される。また、このVUは天然の塩基と比較し長波長側にUV吸収を持つことから選択的な励起が可能である。
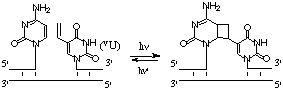
3-2.可逆的な光連結反応(図2)
5′末端にVUを含む核酸を固相合成法により全自動合成機を用いて合成し、鋳型核酸存在下、366 nmの長波長によりこの修飾塩基のみを選択的に励起することで3ユ末端にピリミジンを有する核酸との光連結に成功した。興味深いことに短波長(302 nm)光照射することでこの光連結部位で開裂が可能であることも見いだした。このことにより二つの波長を用いることで可逆的に核酸同士を連結させることに成功した。光による方法は、酵素や試薬などを一切加える必要がなく、高温から低温までの幅広い温度範囲で行うことができる上、光ファイバーを用いて細胞内や組織内でも行うことも可能であるので、その応用範囲はきわめて広いものと考えられる。
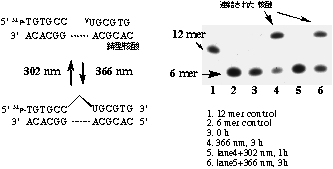
図2 可逆的な核酸の光連結
4.光を用いた核酸連結反応の応用
4-1.酵素にはできない核酸合成
ビニルウラシル(VU)の反応性をさらに改良した5カルボキシビニルウラシル(CVU)を用いることで、枝分かれ核酸・末端がキャップされた核酸・環状核酸等、最もよく用いられるリガーゼでは合成が不可能であった様々な構造を有する核酸の調整を光連結によって成功した(図3)。枝分かれ核酸は、通常の核酸の持つ情報にさらに人為的に情報を付け加えた構造を有しており、あたかも荷札をつけた核酸になぞらえることもできる。最近、枝分かれ核酸は信号の増幅・3本鎖核酸の安定化・ナノ構造の構築等に有用であることも報告されている。末端がキャップされた核酸は、キャップされていない核酸と比較して異常な熱安定性を有しており、細胞内で核酸を分解する酵素に対して耐性を獲得している。この酵素を用いない光を用いた核酸連結反応を用いることで、非常にユニークな構造を有する核酸を簡単に調整することが可能になった。
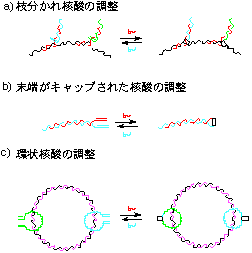
図4 枝分かれ核酸を用いた応用例
4-2.任意のシトシンをウラシルへと変異させる
アデノシンデアミナーゼに代表される様に生体内では塩基上のアミノ基を酸化する酵素があるが位置特異的な反応ではない。今回、既に開発済みの可逆的な枝分かれ核酸合成反応を応用し、アミノ基の酸化反応と組み合わせることで、任意の位置のシトシンをウラシルへと変異させることに成功した(図5)。
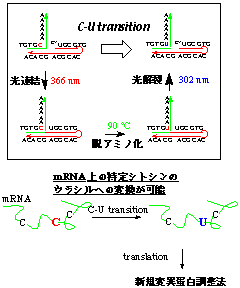
図5 可逆的な核酸光連結を用いた応用例(任意のシトシンをウラシルへと変異させる)
5.最後に
核酸を光化学的に操作する手法の開発は、従来の酵素を用いた遺伝子工学ではできなかった様な次世代遺伝子工学の開発につながる重要な基礎研究として位置づけることが可能である。今後、実際に遺伝子レベルでの長鎖DNAに対して本当に使用できる技術なのかどうか検討する必要がある。いずれにせよ遺伝子操作の「脱酵素化」に取り組み、光応答型遺伝子操作という新しい方法論を立ち上げ、酵素が苦手としていた生体内細胞中での操作、マイクロマシン上での遺伝子診断、バイオコンピューティングといった方面への展開も行っていきたい。